Fyziku štruktúry hmoty prvýkrát vážne študoval Joseph J. Thomson. Mnoho otázok však zostalo nezodpovedaných. Po chvíli, uh. Rutherford bol schopný formulovať model štruktúry atómu. V článku sa pozrieme na skúsenosti, ktoré ho viedli k objavu. z T. k. na hodinách fyziky je štruktúra hmoty jednou z najzaujímavejších tém, budeme analyzovať jej kľúčové aspekty. Poďme zistiť, z čoho pozostáva atóm, Naučme sa, ako v ňom nájsť počet elektrónov, protónov, neutrónov. Zoznámime sa s konceptom izotopov a iónov.
Objav elektrónu
V roku 1897 sa. Anglický vedec Joseph John Thomson (jeho portrét je možné vidieť nižšie) študoval elektrický prúd,. teda. smerový pohyb nábojov v plynoch. V tom čase už fyzika vedela o molekulárnej štruktúre hmoty. Bolo známe, že všetky telá pozostávajú z hmoty, ktorá pozostáva z molekúl a druhá z atómov.

Thomson zistil, že za určitých podmienok atómy plynu emitujú častice so záporným nábojom (q <0). Nazývajú sa elektróny. Atóm je neutrálny, čo znamená, že ak z neho vyletia elektróny, musia tam byť obsiahnuté aj pozitívne častice. Aká je časť atómu so znakom "+"? Ako interaguje so záporne nabitým elektrónom? Čo určuje hmotnosť atómu? Ďalší vedec bol schopný odpovedať na všetky tieto otázky.
Rutherfordova skúsenosť
Prvotné informácie o štruktúre hmoty v roku 1911. už vlastnené. Ernest Rutherford objavil to, čo dnes nazývame atómové jadro.

Existujú látky, ktoré majú zvláštnu vlastnosť: spontánne emitujú rôzne častice, , obe pozitívne, a negatívne. Takéto látky sa nazývali rádioaktívne. Pozitívne nabité prvky Rutherford nazývané alfa častice (α-častice).
Majú poplatok so znakom "+", rovná sa dvom elementárnym (qα = + 2e). Hmotnosť prvkov sa približne rovná štyrom hmotnostiam atómu vodíka. Rutherford vzal rádioaktívny liek, ktorý emituje alfa častice, a svojím tokom bombardoval tenký film zlata (fólie.
Zistil, že väčšina α-prvkov pri prechode atómami kovov takmer nemení svoj smer. Existuje však veľmi malý počet tých, ktoré sa odchyľujú späť. Prečo sa to deje? Keď poznáme fyziku štruktúry hmoty, môžeme odpovedať: pretože vo vnútri atómov zlata, ako každý iný, existujú pozitívne prvky, ktoré odpudzujú častice alfa. Prečo sa to však deje iba s veľmi malým počtom prvkov? Pretože veľkosť kladne nabitej časti atómu je oveľa menšia ako samotná. Rutherford dospel k tomuto záveru. Pozitívne nabitú časť atómu nazval jadrom.
Štruktúra atómu
Fyzika štruktúry hmoty: molekuly pozostávajú z atómov, ktoré obsahujú malú kladne nabitú časť (jadro) obklopenú elektrónmi. Neutralita atómu sa vysvetľuje skutočnosťou , že celkový záporný náboj elektrónov sa rovná pozitívnemu náboju-jadrám. qz jadra + qel= 0. Prečo elektróny nespadajú na jadro, pretože sú priťahované? Odpovedať v tejto otázke Rutherford navrhol, aby sa otáčali, keď sa planéty pohybujú okolo Slnka a nezrážajú sa s ním. Je to pohyb, ktorý umožňuje, aby bol tento systém stabilný. Model atómu, ktorý vynašiel Rutherford, sa nazýval planetárny.
Ak je atóm neutrálny a počet elektrónov v ňom musí byť nevyhnutne celé číslo, potom sa náboj jadra rovná tejto hodnote so znamienkom plus. qz jadra= + z * e. z je počet elektrónov v neutrálnom atóme. V tomto prípade je celkový poplatok nulový. Ako zistiť číslo elektrónov v atóme? Musíte použiť periodický systém prvkov. Rozmery atómu sú rádovo 10-10 m. A jadrá sú 100 tisíc krát menšie-10-15 m.
Predstavte si, že sme zväčšili veľkosť jadra na 1 meter. V pevnej látke je vzdialenosť medzi atómami približne rovnaká ako ich veľkosť, čo znamená, že veľkosť sa zvýši na 105, a to je 100 km. To znamená, že atóm prakticky pozostáva z prázdnoty, a preto častice alfa väčšinou lietajú cez fóliu, takmer bez odchýlenia sa.
Štruktúra jadra
Fyzika štruktúry hmoty je taká, že jadro pozostáva z dvoch druhov častíc. Niektoré z nich majú kladný náboj. Ak vezmeme do úvahy atóm s tromi elektrónmi, potom sú v ňom tri častice s kladným nábojom. Nazývajú sa protóny. Ostatné prvky nemajú elektrický náboj-neutróny.

Hmotnosti protónu a neutrónu sú približne rovnaké. Obe častice majú hmotnosť oveľa väčšiu ako elektrón. mz protónu 1837mel. To isté platí pre hmotnosť neutrónu. Z toho vyplýva záver: hmotnosť pozitívne a neutrálne nabité častice - faktor určujúci hmotnosť atómu. Protóny a neutróny majú spoločný názov-nukleóny. Hmotnosť atómu je určená ich počtom, ktorý sa nazýva hmotnostné číslo jadra. Počet elektrónov v atóme sme určili písmenom z, ale. . ak je neutrálny, potom číslo pozitívnych a negatívnych častice sa musia zhodovať. Preto sa z nazýva aj protónové alebo nabíjacie číslo.
Ak sú známe čísla hmotnosti a náboja, potom môžeme nájsť aj počet neutrónov N. N = A-z. Ako zistiť, koľko nukleónov a protónov je v jadre? Ukazuje sa, že v periodickej tabuľke je vedľa každého prvku uvedené číslo, ktoré chemici nazývajú relatívna atómová hmotnosť.

Ak to zaokrúhlime nahor, nedostaneme nič viac ako hmotnostné číslo alebo počet nukleónov v jadre (A). Poradové číslo prvku je počet protónov (z). Keď poznáte A A z, je ľahké nájsť N-počet neutrónov. Ak je atóm neutrálny, potom je počet elektrónov a protónov rovnaký.
Izotopy
Existujú odrody jadra, v ktorých sa počet protónov zhoduje a počet neutrónov sa môže líšiť (čo znamená ten istý chemický prvok). Nazývajú sa izotopy. V prírode sú atómy rôznych odrôd zmiešané, takže chemici merajú priemernú hmotnosť. Preto je v periodickej tabuľke relatívna hmotnosť atómu vždy zlomkové číslo. Poďme zistiť, čo sa stane s neutrálnym atómom, ak z neho odstránite elektrón alebo naopak vložíte ďalší.
Ión

Zvážte neutrálny atóm lítia. Existuje jadro, dva elektróny sú umiestnené na jednom obale a tri na druhom. Ak vezmeme jeden z nich, dostaneme kladne nabité jadro. z Qjadro = 3e. Elektróny kompenzujú iba dva z troch elementárnych nábojov a dostaneme kladný ión. Označuje sa ako: Li+. Ión je atóm, ktorého počet elektrónov je menší alebo väčší ako počet protónov v jadre. V prvom prípade ide o pozitívny ión. Ak pridáme ďalší elektrón, už ich budú štyri a dostaneme negatívny ión (Li-). Taká je fyzika štruktúry hmoty. Neutrálny atóm sa teda líši od iónu tým, že elektróny v ňom úplne kompenzujú náboj jadra.
 Plastické hmoty: klasifikácia, hlavné charakteristiky, výrobné a spracovateľské technológie
Plastické hmoty: klasifikácia, hlavné charakteristiky, výrobné a spracovateľské technológie Ako vyniknúť zo šedej hmoty?
Ako vyniknúť zo šedej hmoty? Break-even je... Vzorec na výpočet bodu zlomu
Break-even je... Vzorec na výpočet bodu zlomu Čo jesť po tréningu pre rast svalov? Vlastnosti výživy na získanie svalovej hmoty
Čo jesť po tréningu pre rast svalov? Vlastnosti výživy na získanie svalovej hmoty Sacharidy na získanie svalovej hmoty: zoznam produktov, požadované množstvo spotreby
Sacharidy na získanie svalovej hmoty: zoznam produktov, požadované množstvo spotreby Ako zistiť číslo gua: metódy výpočtu a vzorce
Ako zistiť číslo gua: metódy výpočtu a vzorce Smerový pohyb nabitých častíc: definícia, charakterizácia, fyzikálne vlastnosti a aplikácia
Smerový pohyb nabitých častíc: definícia, charakterizácia, fyzikálne vlastnosti a aplikácia Aká je energetická hladina v chémii?
Aká je energetická hladina v chémii?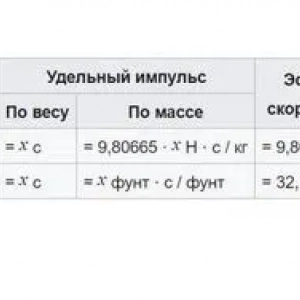 Špecifický impulz: definícia pojmu, charakteristika, výpočet
Špecifický impulz: definícia pojmu, charakteristika, výpočet