Acetylenid meďnatý je organokovová binárna zlúčenina. Tento vzorec je vede známy najmenej od roku 1856. V kryštáloch tvorí monohydrát so vzorcom Cu2C2× H2O. je tepelne nestabilný, pri zahrievaní exploduje.
Budova
Acetylenid medi je binárna zlúčenina. Záporne nabitú časť je možné podmienečne izolovaťv ňom− anión C2-2, a kladne nabitý-cu medené katióny+. V skutočnosti je toto rozdelenie podmienené: v zlúčenine je iba zlomok iónovej väzby, aj keď je väčšia v porovnaní s väzbou H-C≡. Ale táto väzba má tiež veľmi silnú polaritu( ako pri kovalentnej) v dôsledku skutočnosti, že atóm uhlíka s trojitou väzbou je v sp-hybridizácii - jeho relatívna elektronegativita je väčšia ako pri sp hybridizáciách3 (jeden odkaz) alebo sp2 (dvojitá väzba). To umožňuje uhlíku v acetyléne relatívne ľahko odštiepiť atóm vodíka a nahradiť ho atómom kovu, to znamená vykazovať vlastnosti obsiahnuté v kyselinách.

Prijímajúci
Najbežnejšou metódou získavania acetylenidu medi v laboratóriu je prechod acetylénového plynu cez roztok amoniaku chloridu meďnatého (I). V dôsledku toho sa vytvorí nerozpustná zrazenina červenkastého acetylenidu.

Namiesto chloridu meďnatého sa môže použiť aj jeho hydroxid Cu2O. V obidvoch prípadoch je dôležité, aby reakcia skutočne prebiehala s amoniakovým komplexom medi.
Fyzikálne vlastnosti
Čistý acetylenid medi-tmavo červeno-hnedé kryštály. V skutočnosti ide o monohydrát - v sedimente každá molekula acetylénu zodpovedá jednej molekule vody (napísaná ako Cu2C2× H2O). Suchý acetylenid medi je výbušný: môže vybuchnúť pri zahrievaní (je menej tepelne stabilný ako acetylenid strieborný), ako aj pri mechanickom pôsobení, napríklad pri náraze.
V tejto súvislosti existuje predpoklad, že medené rúry v chemickom priemysle sú veľmi nebezpečné, pretože pri dlhodobej prevádzke sa vo vnútri vytvára acetylén, čo môže viesť k silnému výbuchu. Platí to najmä v oblasti petrochémie, kde sa ako katalyzátory používa aj meď a jej acetylenidy, čo zvyšuje úroveň rizika.
Chemické Vlastnosti
Už sme povedali, že uhlík s trojitou väzbou v acetyléne je oveľa elektronegatívnejší ako napríklad uhlík s dvojitou väzbou (ako v etyléne) alebo jednoduchou väzbou (v etáne). Schopnosť acetylénu reagovať s niektorými kovmi, vydávať vodíkový ión a nahradiť ho kovovým iónom (napríklad reakcia tvorby acetylénu sodného pri interakcii acetylénu s kovom sodným) to potvrdzuje. Túto schopnosť acetylénu nazývame jednou z kyslých vlastností v súlade s teóriou Brensted-Lowry: podľa nej kyslosť látky je určená jeho schopnosť oddeliť protón od seba. Kyslosť acetylénu (aj v acetyléne medi) možno považovať za relatívnu k amoniaku a vode: keď amid kovu interaguje s acetylénom, vytvára sa acetylén a amoniak. To znamená, že acetylén vydáva protón, ktorý ho charakterizuje ako a silnejšia kyselina ako amoniak. V prípade vody sa acetylenid meďnatý rozkladá za vzniku acetylénu - vyžaduje protón vody, čo sa ukazuje ako Menej silná kyselina ako voda. Takže v relatívnom rozsahu kyslosti (podľa Brensteda - Lowryho) je acetylén slabá kyselina, ktorá je niekde medzi vodou a amoniakom.
Acetylenid meďnatý je nestabilný: vo vode (ako už vieme) a v kyslých roztokoch sa rozkladá s uvoľňovaním plynného acetylénu a červenohnedej zrazeniny-oxidu meďnatého alebo bielej zrazeniny chloridu meďnatého v prípade riedenia roztokom kyseliny chlorovodíkovej.
Aby sa zabránilo výbuchu, rozklad acetylénu sa uskutočňuje opatrným zahrievaním vo vlhkej forme v prítomnosti silnej minerálnej kyseliny, napríklad zriedenej kyseliny dusičnej.
Používať
Reakcia tvorby acetylenidu meďnatého môže byť kvalitatívna na detekciu terminálnych (s trojitou väzbou na konci) alkínov. Indikátorom je vyzrážanie nerozpustnej červenohnedej zrazeniny acetylénu.
Vo veľkovýrobe - napríklad v petrochémii - sa acetylenid meďnatý nepoužíva, pretože je výbušný a nestabilný vo vode. Je však spojená s niekoľkými špecifickými reakciami v takzvanej jemnej syntéze.
Acetylenid meďnatý sa môže tiež použiť ako nukleofilné činidlo v organickej syntéze. Najmä hrá dôležitú úlohu pri syntéze polyínov-zlúčenín s niekoľkými striedavými trojitými a jednoduchými väzbami. Acetylenidy medi(I) v alkoholovom roztoku sa oxidujú vzdušným kyslíkom a kondenzujú za vzniku diínov. Toto je Glazer-Ellingtonova reakcia, objavená v roku 1870 a neskôr vylepšená. Meď (I) hrá úlohu katalyzátora tu, pretože nie je spotrebovaný v samotnom procese.

Neskôr, namiesto kyslíka, hexacyanoferát draselný (III) bol navrhnutý ako oxidačné činidlo.
Ellington zlepšil spôsob získavania polyínov. Namiesto alkínov a solí medi(i) pôvodne zavedených do roztoku, napríklad chloridu, navrhol užívať octan meďnatý, ktorý by oxidoval alkín v médiu iného organického rozpúšťadla-pyridínu - pri teplote 60-70 ° C.

Táto modifikácia umožnila získať oveľa väčšie a stabilnejšie molekuly z diínov-makrocyklov.
 Herb medunitsa: liečivé vlastnosti a kontraindikácie, popis, príprava, spôsoby aplikácie
Herb medunitsa: liečivé vlastnosti a kontraindikácie, popis, príprava, spôsoby aplikácie Ako variť šípku: príprava, užitočné vlastnosti, výhody použitia a kontraindikácie
Ako variť šípku: príprava, užitočné vlastnosti, výhody použitia a kontraindikácie Borohydrid sodný: vlastnosti, príprava a aplikácia
Borohydrid sodný: vlastnosti, príprava a aplikácia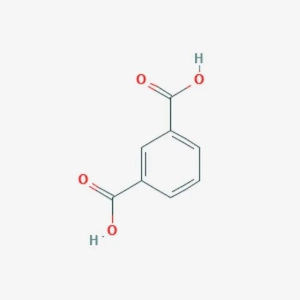 Kyselina izoftalová: popis, vlastnosti, príprava a aplikácia
Kyselina izoftalová: popis, vlastnosti, príprava a aplikácia Scenár pre deň ruska: vlastnosti dovolenky, príprava
Scenár pre deň ruska: vlastnosti dovolenky, príprava Ct pľúc s kontrastom: indikácie, príprava, vlastnosti postupu, interpretácia výsledkov
Ct pľúc s kontrastom: indikácie, príprava, vlastnosti postupu, interpretácia výsledkov Hypofosfit sodný, vlastnosti, príprava, aplikácia
Hypofosfit sodný, vlastnosti, príprava, aplikácia Vlastnosti a príprava ryžového čaju. Najlepšie užitočné vlastnosti čaju genmaycha
Vlastnosti a príprava ryžového čaju. Najlepšie užitočné vlastnosti čaju genmaycha Súlad je... Definícia, charakterové vlastnosti, osobnostné vlastnosti
Súlad je... Definícia, charakterové vlastnosti, osobnostné vlastnosti